生薬試験法は、生薬総則に規定する生薬に適用する試験法である。
試料の採取
別に規定するもののほか、次の方法によって試料を採取し、必要ならば気密容器に保存する。
(1)小形の生薬、切断生薬及び粉末生薬は、よくかき混ぜた後、試料50~250
gを採取する。
(2)大形の生薬はよくかき混ぜた後、試料250~500
gを採取する。
(3)1個の重量が100
g以上の生薬は5個以上を採取し、試料とするか、又は生薬を適当な大きさに切断してよくかき混ぜた後、試料500
g以上を採取する。
分析用試料の調整
試料をよく混ぜ、粉末生薬はそのまま、粉末生薬でないものは、別に規定するもののほか、粉末とし、もし、粉末にできないものは、なるべく細かくした後、薄く広げて平均した部分をとり、分析用試料とする。必要ならば気密容器に保存する。
鏡 検
(1)装置
光学顕微鏡を使用する。対物レンズは10倍及び40倍を、接眼レンズは10倍を用いる。
(2)鏡検用プレバラートの作成
(i)切片 切片をスライドガラス上にとり、封入剤1~2滴を滴加した後、気泡が封入されないように注意してカバーガラスで覆う。観察に用いる切片の厚さは、通例、10~20µmとする。
(ii)粉末 粉末の試料約0.1gを膨潤剤2~3滴を滴加した時計皿にとり、気泡が入らないように小ガラス棒の先でよくかき混ぜた後、10分間以上放置して試料を膨潤させる。膨潤した試料の少量をガラス棒の先でスライドガラスに塗抹し、その上に封入剤1滴を滴加した後、組織片が重ならないようにほほ均等に広がり,また気泡が封入されないように注意してカバーガラスで覆う。
封入制及び膨潤剤は、別に規定するもののほか、水/グリセリン混液(1:1)を用いる。
(3)性状の項の各要素の観察
切片は、通例、外側から内側に向かい、次いで細胞内容物の順に医薬品各条に記載されており、この順に観察する。粉末は、特徴的なもの又は多量に出現するもの、まれに現れるもの、次いで細胞内容物の順に医薬品各条に記載されており、この順に観察する。
純度試験
(1)異 物
別に規定するもののほか、試料25~500
gを量り、薄く広げて生薬中の異物を肉眼又は10倍のルーペを用いて選びだし、その重量を量り、異物の量(%)とする。
(2)総BHC及び総DDT
生薬の粉末約5 gを精密に量り、共栓遠心沈殿管に入れ、生薬純度試験用アセトン/水混液(5 : 2) 30 mLを加え、密栓して15分間振り混ぜた後、遠心分離し、上澄液を分取する。残留物は、更にこの操作を2回行い、全抽出液を合わせ、減圧、40℃以下で濃縮する。濃縮液を塩化ナトリウム試液100 mLを入れた分液漏斗に移し、5分間振り混ぜる。ヘキサン層をとり、無水硫酸ナトリウム30 gを用いて乾燥した後、ろ過する。残留物を生薬純度試験用ヘキサン20 mLで洗い、ろ液及び洗液を合わせ、減圧、40℃以下で濃縮して約5 mLとする。この液をカラムに入れ、生薬純度試験用ヘキサン/生薬純度試験用ジエチルエーテル混液(17 : 3) 300 mLを用いて1分間に5 mL以下の速度で流出する。全流出液を減圧、 40℃以下で濃縮し、生薬純度試験用ヘキサンを加えて正確に5 mLとする。この液を共栓付き試験管に移し、水2 mLを加えて、軽く振り混ぜる。続いてこの上層液から3 mLを共栓付き遠心管に移し、無水硫酸ナトリウム1 gを用いて乾燥した後、遠心分離して上澄液を試料溶液とする。別に作成したα-BHC、β-BHC、γ-BHC、δ-BHC、o,p'-DDT、p,p'-DDT、p,p'-DDD、p,p'-DDE、それぞれの 1 mg/10 mLヘキサン溶液を標準液としてガスクロマトグラフィーで試験を行い、ピーク面積によりそれぞれの量を求める。
各BHC量の合計を総BHC量(ppm)、各DDT量の合計を総DDT量(ppm)とする。
乾燥減量
別に規定するもののほか、分析用試料2~6
gをあらかじめ重量を量ったはかり瓶に人れ、その重量を精密に量り、105℃で5時間乾燥し、デシケーター(シリカゲル)で放冷し、その重量を精密に量る。再びこれを105℃で乾燥し、1時間ごとに重量を精密に量り、恒量になったときの減量を乾燥減量(%)とする。ただし、乾燥時間の規定があるときは、規定された時間乾燥した後、重量を精密に量り、その減量を乾燥減量(%)とする。
灰 分
あらかじめ白金製、石英製又は磁製のるつぼを500~550℃で1時間強熱し、放冷後、その重量を精密に量る。別に規定するもののほか、分析用試料2~4
gを採取し、前のるつぼに入れ、その重量を精密に量り、必要ならばるつぼのふたをとるか、又はずらし、初めは弱く加熱し、徐々に温度を上げて500~550℃で4時間以上強熱して、炭化物が残らなくなるまで灰化する。放冷後、その重量を精密に量る。再び残留物を、恒量になるまで灰化し、放冷後、その重量を精密に量り、灰分の量(%)とする。この方法で、なお炭化物が残り、恒量にならないときは、熱湯を加えて浸出し、定量用ろ紙を用いてろ過し、残留物はろ紙及びろ紙上の不溶物と共に炭化物がなくなるまで強熱する。これにろ液を加えた後、蒸発乾固し、強熱する。放冷後、重量を精密に量り、灰分の量(%)とする。この方法でも炭化物が残るときは、エタノール(95)少量を加えて潤し、ガラス棒で炭化物を砕き、ガラス棒をエタノール(95)少量で洗い、エタノールを注意して蒸発した後、前と同様に操作して灰分を量る。放冷はデシケーター(シリカゲル)で行う。
酸不溶性灰分
灰分に希塩酸25 mLを注意して加え、5分間穏やかに煮沸し、不溶物を定量用ろ紙を用いてろ取し、熱湯でよく洗い、残留物をろ紙と共に乾燥した後、灰分の項と同様に操作した重量既知の白金製、石英製又は磁製のるつぼ中で3時間強熱し、デシケーター(シリカゲル)で放冷後、その重量を精密に量り、酸不溶性灰分の量(%)とする。得た値が規定の値より大きい場合は、恒量になるまで強熱する。
エキス含量
エキス含量の試験は次の定量法によって行う。
(1)希エタノールエキス定量 別に規定するもののほか、分析用試料約2.3
gを精密に量り、適当なフラスコに入れ、希エタノール70 mLを加え、時々振り混ぜて5時間浸出し、更に16~20時間
放置した後、ろ過する。フラスコ及び残留物は、ろ液が100 mLになるまで希エタノールで洗う。ろ液50mLを水浴上で蒸発乾固し、105℃で4時間乾燥し、デシケーター(シリカゲル)で放冷後、その重量を精密に量り、2を乗じて希エタノールエキスの量とする。乾燥減量によって得た数値より乾燥物に換算した試料量に対し、エキス含有(%)を算出する。
(2)水製エキス定量法 (1)の希エタノールの代わりに水を用いて同様に操作し、その重量を精密に量り、2を乗じて水製エキスの量とする。乾燥減量によって得た数値より乾燥物に換算した試料量に対し、エキス含量(%)を算出する。
(3)エーテルエキス定量 別に規定するもののほか、分析用試料をデシケーター(シリカゲル)で48時間乾燥し、その約2
gを精密に量り、適当なフラスコに入れ、エーテル70 mLを加え、還流冷却器を付け、水浴上で4時間穏やかに煮沸し、放冷後、ろ過する。フラスコ及ぴ残留物は、ろ液が100 mLになるまでエーテルで洗う。ろ液50 mLを水浴上で蒸発乾固し、デシケーター(シリカゲル)
で24時間乾燥し、その重量を精密に量り、2を乗じてエーテルエキスの呈とし、エキス含量(%)を算出する。
精油含量
精油含量の試験は次の精油定量法により行う。
精油定量法
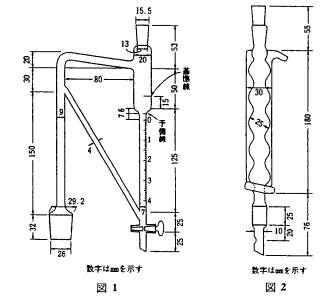
医薬品各条に規定する量の分析用試料を、1
Lの共通すり合わせ硬質ガラスフラスコに入れ、5~10倍量の水を加えた後、精油定量器(図1)を装置し、定量器の上端に還流冷却器(図2)を付け、油浴中で注意して130~150℃で加熱し、沸騰させる。定量器の目盛り管には、あらかじめ水を基準線まで入れ、更にキシレン2.0 mLを加えておく、別に規定するもののほか、5時間沸騰を続けた後、加熱をやめ、しばらく放置した後、定量器の活栓を開き、水を徐々に流出させ、油層の上端を目盛り管の予備線にほほ一致させ、常温でl時間以上放置する。次に油層の上面を目盛り管のゼ口線まで低下させ、常温で油屋(mL)を量り、キシレンの量を減じて生薬中の精油量とする。
生薬の微生物限度試験法
生薬の微生物限度試験法は、生薬に存在する増殖能力を有する特定の微生物の定性、定量試験法である。本試験法には生菌数試験(好気性細菌と真菌)及び特定微生物試験(腸内細菌とその他のグラム陰性菌、大腸菌、サルモネラ及び黄色ブドウ球菌)が含まれる。試験を遂行するに当たって、外部からの微生物汚染が起らないように、細心の注意を払う必要がある。また、被検試料が抗菌作用を有する場合又は抗菌作用を持つ物質が混在する場合は、希釈、ろ過、中和又は不活性化などの手段によりその影響を除去しなければならない。試料は任意に選択した異なる数箇所(又は部分)から採取したものを混和し用いる。試料を液体培地で希釈する場合は、速やかに試験を行う。また、本試験を行うに当たっては、特にサルモネラを扱う場合、バイオハザード防止に十分留意する。(操作法は省略する)