isoflavonoidは天然界では主にマメ科植物に分布する1,2-diphenylpropane骨格を有する一群の酸素複素環化合物(1)である。これら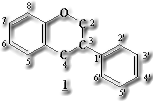 の化合物はflavonoid生合成系のflavanoneが1,2-aryl転移を経てisoflavoneに変換され、更に酸化、還元、環化反応などにより各種のisoflavonoidを生成する。抗菌、抗酸化、酵素阻害作用など多様な生物活性が知られており、特に微生物感染に呼応して植物体内で新規に生合成が誘導されて生成する抗菌防御物質であるphytoalexinはマメ科植物においては全てisoflavonoidである。1)しかしながらその構造的特徴といえば官能基として芳香族水酸基やmethoxyl基のほかprenyl基やchromene環を有するのが目立つ程度で、不斉炭素を有し立体化学的に複雑なものは少ないため、合成化学上の興味の対象とはなりにくいこともあってisoflavonoidを対象とした医薬品化学的研究は一般に低調である。我々はその中で、近年牧草アルファルファから単離されたisoflavonoidの一種coumestrol (2) が天然有機化合物としては例の少ない骨吸収抑制作用を有し、これからipriflavone (3) なる骨粗鬆症治療薬が創製されていることに着目した。2)高齢化社会の
の化合物はflavonoid生合成系のflavanoneが1,2-aryl転移を経てisoflavoneに変換され、更に酸化、還元、環化反応などにより各種のisoflavonoidを生成する。抗菌、抗酸化、酵素阻害作用など多様な生物活性が知られており、特に微生物感染に呼応して植物体内で新規に生合成が誘導されて生成する抗菌防御物質であるphytoalexinはマメ科植物においては全てisoflavonoidである。1)しかしながらその構造的特徴といえば官能基として芳香族水酸基やmethoxyl基のほかprenyl基やchromene環を有するのが目立つ程度で、不斉炭素を有し立体化学的に複雑なものは少ないため、合成化学上の興味の対象とはなりにくいこともあってisoflavonoidを対象とした医薬品化学的研究は一般に低調である。我々はその中で、近年牧草アルファルファから単離されたisoflavonoidの一種coumestrol (2) が天然有機化合物としては例の少ない骨吸収抑制作用を有し、これからipriflavone (3) なる骨粗鬆症治療薬が創製されていることに着目した。2)高齢化社会の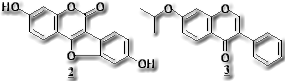 到来が秒読みに入った今、老人病の代表ともいえる骨粗鬆症治療薬の需要の増加は確実と考えられている。我々はisoflavonoidの多様な骨格の中にはまだより優れた骨吸収抑制作用を有するものが潜んでいると考え、各種isoflavonoidの合成研究に着手するに至った。その結果、thallium trinitrate(TTN)によるflavanoneのisoflavoneへの直接変換、3-arylcoumarinから2-arylbenzofuranへの環縮小反応に成功し、これを用いて各種isoflavonoidを合成した。
到来が秒読みに入った今、老人病の代表ともいえる骨粗鬆症治療薬の需要の増加は確実と考えられている。我々はisoflavonoidの多様な骨格の中にはまだより優れた骨吸収抑制作用を有するものが潜んでいると考え、各種isoflavonoidの合成研究に着手するに至った。その結果、thallium trinitrate(TTN)によるflavanoneのisoflavoneへの直接変換、3-arylcoumarinから2-arylbenzofuranへの環縮小反応に成功し、これを用いて各種isoflavonoidを合成した。
(1).isoflavoneの新規合成法--flavanoneのisoflavoneへの直接変換
isoflavoneはflavonoidからisoflavonoidへの分岐点に位置するisoflavonoid biosynthesisの鍵物質であり、flavanoneを直接の前駆体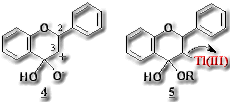 とする。近年、isoflavone synthaseの存在が確認され、当初はflavanone-3,4-enolepoxideの開裂により3位にcarbonyl cation (4) が生成し2位のaryl基が転移するという反応機構が提出されていた。3)(4)とflavanone enolateにTl(III)が付加した仮想中間体(5)は化学的に等価であることからflavanoneをisoflavoneに変換可能と考え、実験を行った。flavanoneにenolを誘導するために反応液にTTNとともに過塩素酸を加え、最終濃度を約15%とし、これに各種置換基をもつflavanone derivativesを加え、室温下、5~12時間撹拌した。いずれの場合にも副産物としてflavone (8)が生成し4)、本反応はScheme 1に示すような機構で進行すると考えられる。
とする。近年、isoflavone synthaseの存在が確認され、当初はflavanone-3,4-enolepoxideの開裂により3位にcarbonyl cation (4) が生成し2位のaryl基が転移するという反応機構が提出されていた。3)(4)とflavanone enolateにTl(III)が付加した仮想中間体(5)は化学的に等価であることからflavanoneをisoflavoneに変換可能と考え、実験を行った。flavanoneにenolを誘導するために反応液にTTNとともに過塩素酸を加え、最終濃度を約15%とし、これに各種置換基をもつflavanone derivativesを加え、室温下、5~12時間撹拌した。いずれの場合にも副産物としてflavone (8)が生成し4)、本反応はScheme 1に示すような機構で進行すると考えられる。
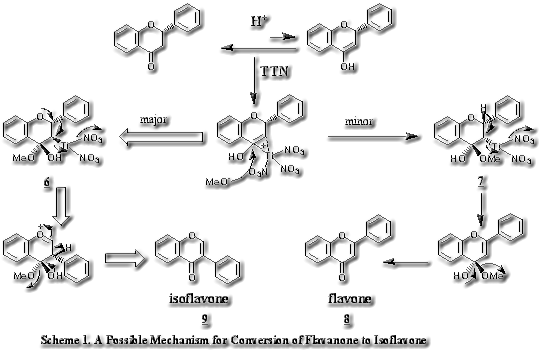
まず、第一段階としてenolにTTNが付加(methoxythallation)し、2-aryl基に対してanti (6)とsyn (7)の2種の付加体を中間体として生成する。立体化学的に有利なanti (6)の生成が優先し、Tl(III)の脱離(dethallation)とともに協奏的に2-aryl基が転移しisoflavone (9)を生成する。syn 付加体 (7)ではdethallationにおいて2-aryl基はTl(III)とsynの位置にあるので転移しにくく、替わりにantiの位置にある水素が脱離しflavone (8)を生成する。C-Tl結合の開裂が2-aryl基の転移の前に完結していれば2-aryl基転移よりむしろ水素の脱離によるflavoneの生成が優先すると考えられるので、dethallationと2-aryl migrationは協奏的、すなわちSN2反応で起こると思われる。B環のパラ位(C-4')にハロゲンのような電子吸引性の強い官能基を有する場合は2-aryl基の転移能を阻害すると考えられたが、本反応はごく円滑にかつ高収量で進行したことは注目に値する。各種フラバノンにおけるisoflavone、flavoneの収量は下の表に示す。
| Substitution | Yields (%) | ||||||
| 5 | 6 | 7 | 2' | 3' | 4' | isoflavone | flavone |
| H | H | H | H | H | H | 65 | 13 |
| H | H | H | H | H | Me | 63 | 15 |
| H | H | H | H | H | OMe | 59 | 9 |
| H | H | H | H | H | F | 75 | 10 |
| H | H | H | H | H | Cl | 65 | 7 |
| H | H | H | H | H | Br | 73 | 8 |
| H | H | OMe | H | H | OMe | 28 | 6 |
| H | H | OMe | H | H | H | 48 | 10 |
| H | H | OMe | H | H | F | 57 | 14 |
| H | H | OMe | OMe | H | OMe | 34 | 5 |
| OMe | H | OMe | H | H | OMe | 28 | 6 |
| H | H | OBz | H | H | OMe | 29 | 7 |
| H | OMe | OMe | H | OMe | H | 25 | 6 |
(2).3-arylcoumarinのring contractionによる2-arylbenzofuranの新規合成法
2-arylbenzofuranはC6-C2-C6骨格を有する化合物で天然物として数は多くはないが、phytoalexinとして知られるものが多く生物活性も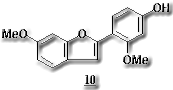 強いことから注目を集めている。vignafuran (10)は病原菌に感染したVigna unguiculataの葉から単離されたphytoalexinである。生合成的にはisoflavonoidに類縁をもつマメ科起源のものとstilbeneが閉環して生成したものと考えられるクワ科起源のものと2グループに大別される。5)isoflavonoid起源のものはヘテロ環からC1単位が脱離して生合成されることがわかっている5)が、詳細については不明である。我々はこれをヒントにして最も簡単に構築できるisoflavonoid骨格である3-arylcoumarin (11)から2-arylbenzofuran (18)への変換に成功した。この反応工程は新規の反応を含み、かつisoflavonoid起源の2-arylbenzofuranの推定生合成経路の有力な化学的根拠となりうるものと考えその反応機構について詳細に検討した。未置換の3-arylcoumarin (11)をAlH3で還元しジオール(12)とし、ベンゼン中でDDQ (2,3-dichloro-5,6-dicyanobenzoquinone)とともに還流すると2-arylbenzofuran (18) を32%の収量で得たほか、isoflav-3-eneのダイマーである2,2'-oxy-diisoflav-3-ene (16)を30%、3-arylcoumarin (11)を6%、更にparaformaldehydeの昇華物を認めた。6)この反応機構(Scheme 2に示す)によれば(12)のhydroxymethylがDDQにより酸化されてaldehyde (13)となり、異性化して2-OH-isoflav-3-ene (14)となった後、酸触媒(DDQH2)により環縮小が起きて中間体である2-aryl-2-formyl-2,3-dihydrobenzofuran (17)を生成、さらに脱フォルミル化を経て(18)を生成すると思われる。またisoflav-3-eneのダイマー(16)は2-OH-isoflav-3-ene (14)が脱水縮合して生成するものと考えられる。
強いことから注目を集めている。vignafuran (10)は病原菌に感染したVigna unguiculataの葉から単離されたphytoalexinである。生合成的にはisoflavonoidに類縁をもつマメ科起源のものとstilbeneが閉環して生成したものと考えられるクワ科起源のものと2グループに大別される。5)isoflavonoid起源のものはヘテロ環からC1単位が脱離して生合成されることがわかっている5)が、詳細については不明である。我々はこれをヒントにして最も簡単に構築できるisoflavonoid骨格である3-arylcoumarin (11)から2-arylbenzofuran (18)への変換に成功した。この反応工程は新規の反応を含み、かつisoflavonoid起源の2-arylbenzofuranの推定生合成経路の有力な化学的根拠となりうるものと考えその反応機構について詳細に検討した。未置換の3-arylcoumarin (11)をAlH3で還元しジオール(12)とし、ベンゼン中でDDQ (2,3-dichloro-5,6-dicyanobenzoquinone)とともに還流すると2-arylbenzofuran (18) を32%の収量で得たほか、isoflav-3-eneのダイマーである2,2'-oxy-diisoflav-3-ene (16)を30%、3-arylcoumarin (11)を6%、更にparaformaldehydeの昇華物を認めた。6)この反応機構(Scheme 2に示す)によれば(12)のhydroxymethylがDDQにより酸化されてaldehyde (13)となり、異性化して2-OH-isoflav-3-ene (14)となった後、酸触媒(DDQH2)により環縮小が起きて中間体である2-aryl-2-formyl-2,3-dihydrobenzofuran (17)を生成、さらに脱フォルミル化を経て(18)を生成すると思われる。またisoflav-3-eneのダイマー(16)は2-OH-isoflav-3-ene (14)が脱水縮合して生成するものと考えられる。
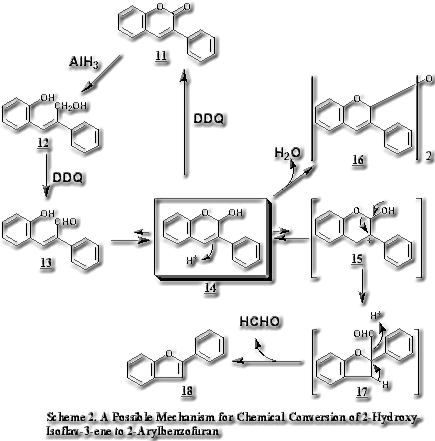
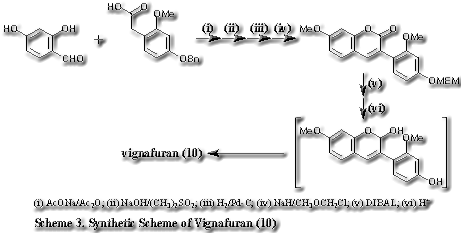
この反応機構は(11)をDIBALで還元して(14)を調製し酸で処理すると(18)が高収量で得られることでも支持される。特に、2-OH-isoflav-3-ene (14) →(17)→2-arylbenzofuran (18)のスキームはマメ科に含まれるマイナーイソフラボノイド2-arylbenzofuranの推定生合成経路としても興味がある。また、この反応は天然に存在する 2-arylbenzofuranの実用的な合成法としても耐え得るものである。前述のvignafuran (10)をschene 3に示す方法で、(19)から56%のoverall yieldでvignafurann (10)の合成に成功した。一部、2量体も生成するが、酸加水分解で2-arylbenzofuranに変換できるので実質的な収量はもっとよい。
引用文献
- Dewick,P. M., In "The Flavonoids: Advances in Research" (eds. Harborne, J. B. and T. J. Mabry, T. J.), pp. 535-640,Chapman and Hall, London, 1982.
- Ueno S., Farumashia, 25, 447 (1989).
- Hagmann, M. and Grisebach, H., FEBS Letters, 175, 199 (1984).
- Kinoshita, T., Ichinose, K. and Sankawa, U., Tetrahedron Letters, 1990, 7355.
- Martin, M. and Dewick, P. M., Phytochemistry, 18, 1309 (1979).
- Kinoshita, T., Tetrahedron letters, 1997, 259.