1.モルヒネの鎮痛作用のメカニズムについて
アヘン成分の中で鎮痛薬モルヒネ(Morphine)が医薬としてもっとも重要な存在のはいうまでもないが、なぜモルヒネは鎮痛作用を示すのだろうか?それを理解するには、痛み(疼痛)のメカニズムを知る必要がある。体の組織が損傷ないし損傷を及ぼすような強い刺激を受けるといわゆる痛みを感じる。これは身体の各所に傷害受容体という神経細胞(ニューロン)があり、刺激を感じて神経線維(Aδ線維とC線維の2種類がある)を経て脊髄、更に脳へ伝えられ、肉体的、感情的に不快な感覚として処理、感知されるからである。Aδ線維は突発的な刺激の情報をすばやく伝え、急激に痛みを感じるよう働く。熱いものに触って無意識のうちにそれを避けるよう身体の一部がとっさに動くのは、Aδ線維を経て脳に伝えられた情報にしたがって刺激を回避するよう指令が大脳皮質を経ずに当該部位に伝えられるからである。筋肉痛など内因性刺激による痛みはC線維を経てゆっくり
H-Tyr-Gly-Gly-Phe-Met-OH Methionine enkepharine
H-Tyr-Gly-Gly-Phe-Leu-OH Leucine enkepharine
H-Tyr-Gly-Gly-Phe-Met-Thr-Ser-Glu-Lys-Ser-Gln-Thr-
Pro-Leu-Val-Thhr-Leu-Phe-Lys-Asn-Ala-Ile-Ile-Lys-
Asn-Ala-Tyr-Lys-Lys-Gly-Glu-OH β-Endorphine
情報が伝えられ、たえず痛みを感じるよう働く。一方、強い痛みやストレスを受けると、生体はそれを和らげるような作用をもつ物質が生成することが知られている。1975年、Hughes, Kosterlitzはブタの脳からエンケファリン(Enkepharine)という痛みを抑える作用のある神経伝達物質(neurotransmitter)を単離し、後にヒトなど哺乳動物の脳に広く分布し、脊髄をはじめとする脳以外の神経系にも存在することがわかった。エンケファリンは5個のアミノ酸から構成されるペプチドであり、メチオニンエンケファリン(Methionine enkepharine)、 ロイシンエンケファリン(Leucine enkepharine)の 2種類がある(右図)。また、1979年、京都大学医学部の沼正作らは31個のアミノ酸からなるエンケファリンと同様の作用を持つエンドルフィン(Endorphine)を単離し、N末端の5残基がメチオニンエンケファリンと同じであることを明らかにした。エンドルフィンにはいくつかの種類が知られており、β-エン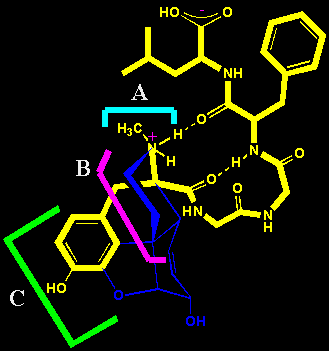 ドルフィンが痛みの神経回路に対してもっとも強力な鎮痛作用を示す。エンドルフィンは、脳下垂体で合成されるプロホルモンであるプロオピオメラノコルチン(Proopiomelanocortin; POMC)から脳下垂体の中葉で切り出されて生成する。エンドルフィンはエンケファリンとともに鎮痛作用のほか、快感ももたらすので内在性オピオイド(体内で生成されるアヘン様物質の意味、オピオイドopioidとはモルヒネ状の作用を示す物質の総称で同じ受容体を介して作用する)と総称される。マラソンのように長距離を走ることは苦痛を伴うものであるが、走ってしばらくすると苦痛が和らぐことが知られている。いわゆる「ランナーズハイ」という現象で、エンドルフィンなどの内在性オピオイドが脳下垂体や視床下部などから分泌されて苦痛を和らげると説明されている。中国の文化大革命時代、麻酔薬を使わない針麻酔が一時的に注目されたことがあったが、決して魔術ではなく針の刺激で内在性オピオイドが分泌され鎮痛作用をもたらすためと現在では説明されている。いわば内在性オピオイドはその名の通り生体がつくる内在性麻薬物質ということができる。モルヒネは植物であるケシが生産する二次代謝物であり、一方、エンケファリンやエンドルフィンは哺乳動物のつくりだす一次代謝物ペプチドであり、系統的には全く関連のない物質である。左図はロイシンエンケファリンとモルヒネをスーパーインポーズしたものである。モルヒネ受容体にはエンケファリンの末端チロシンの4級アンモニウムイオンと結合するアニオンサイト(左図のA)、p-ヒドロキシベンジルという平坦な構造の部分と結合する部分(左図のC)、そしてその間に十分な空間(左図のB)が存在し、それがモルヒネ分子をすっぽりと収納する構造になっているため、結果として鎮痛作用を示すと説明されている。すなわち、モルヒネの鎮痛や多幸感などの快感をもたらす作用は脳や神経系に存在するオピオイド受容体(モルヒネ受容体ともいう)に結合することによってもたらされるものなのである。
ドルフィンが痛みの神経回路に対してもっとも強力な鎮痛作用を示す。エンドルフィンは、脳下垂体で合成されるプロホルモンであるプロオピオメラノコルチン(Proopiomelanocortin; POMC)から脳下垂体の中葉で切り出されて生成する。エンドルフィンはエンケファリンとともに鎮痛作用のほか、快感ももたらすので内在性オピオイド(体内で生成されるアヘン様物質の意味、オピオイドopioidとはモルヒネ状の作用を示す物質の総称で同じ受容体を介して作用する)と総称される。マラソンのように長距離を走ることは苦痛を伴うものであるが、走ってしばらくすると苦痛が和らぐことが知られている。いわゆる「ランナーズハイ」という現象で、エンドルフィンなどの内在性オピオイドが脳下垂体や視床下部などから分泌されて苦痛を和らげると説明されている。中国の文化大革命時代、麻酔薬を使わない針麻酔が一時的に注目されたことがあったが、決して魔術ではなく針の刺激で内在性オピオイドが分泌され鎮痛作用をもたらすためと現在では説明されている。いわば内在性オピオイドはその名の通り生体がつくる内在性麻薬物質ということができる。モルヒネは植物であるケシが生産する二次代謝物であり、一方、エンケファリンやエンドルフィンは哺乳動物のつくりだす一次代謝物ペプチドであり、系統的には全く関連のない物質である。左図はロイシンエンケファリンとモルヒネをスーパーインポーズしたものである。モルヒネ受容体にはエンケファリンの末端チロシンの4級アンモニウムイオンと結合するアニオンサイト(左図のA)、p-ヒドロキシベンジルという平坦な構造の部分と結合する部分(左図のC)、そしてその間に十分な空間(左図のB)が存在し、それがモルヒネ分子をすっぽりと収納する構造になっているため、結果として鎮痛作用を示すと説明されている。すなわち、モルヒネの鎮痛や多幸感などの快感をもたらす作用は脳や神経系に存在するオピオイド受容体(モルヒネ受容体ともいう)に結合することによってもたらされるものなのである。
アヘンアルカロイドや内在性オピオイドが作用するオピオイド受容体は3つの種類があり、それぞれμ(ミュー)、κ(カッパー)、δ(デルタ)受容体と命名されている。さらに各受容体にはそれぞれ2つの亜型(サブタイプ)が存在するといわれているが、詳細はあまり明らかにされていない。薬物による鎮痛には、主として脊髄上部のμ受容体と脊髄内のκ受容体への刺激が関与していると考えられ、特に強力な鎮痛作用にはμ受容体への作用が重要であるとされている。また、δ受容体も鎮痛に関与するが、脊髄上部、脊髄への相対的寄与についてはまだ明らかではない。薬物の各受容体への相互作用として作動性(agonistic)、拮抗性(antagonistic)の刺激があり、モルヒネはこのいずれの受容体にも作動薬(agonist)として作用する。モルヒネならびにコデイン、テバインなど天然由来類縁体(opioids)とそれをシードとして創製した合成鎮痛薬(synthetic opioids)の受容体への作用は多様であり、それによって鎮痛効果、副作用の発現の程度も異なってくる。下の表1は代表的なオピオイド鎮痛薬の各受容体への作用を要約したものである。
2.モルヒネの構造活性相関について
モルヒネは5つの環が縮合した複雑な分子である。ここではそれぞれの環をA(芳香環)、B(シクロヘキサン環)、C(シクロヘキセン環)、D(ピペリジン環)、E(テトラヒドロフラン環)環と呼び、モルヒネの構造と鎮痛活性との相関について説明する。まず、A環の3-水酸基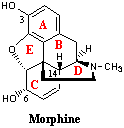 をアルキル化すると鎮痛作用は減少する。例えば、メチル基にする(コデイン;Codeine)と活性は5分の1になる。ただし、生体内ではアルキル基は代謝で除去されてフリーの水酸基になるので鎮痛作用を示す。C環の6-水酸基をケトン体に変換、モルヒノン(Morphinone)にすると活性は3分の1に減少するが、モルヒノンの共役二重結合を還元してジヒドロモルヒノン(Dihydromorphinone)にすると活性は6倍に増加する。モルヒネの6-水酸基を除去したもの、すなわち6-デスオキシモルヒネ(6-Desoxymorphine)は活性は10倍に増強される。6位水酸基を除去すると疎水性が増強され薬物吸収率が向上し、活性を増強すると考えられる。芳香族水酸基の導入は確実に活性を減少させる。E環を開裂すると活性は10分の1になり、また前述のモルヒノンの活性が低いのもC環が異性化して芳香族水酸基となるからである。N-メチル基を除去して2級アミン、すなわちノルモルヒネ(Normorphine;アヘン成分の一つで天然有機化合物だが、微量なのでモルヒネより誘導する。半合成オピオイド鎮痛薬の重要な原料)にすると活性は4分の1に減少するが、そのかわり耽溺性も弱くなる。3級アミンを4級アンモニウム塩にすると鎮痛作用は消滅するが、そのかわりクラーレ(ツボクラリンを含む)様の筋弛緩作用を示す。N-メチル基のかわりにプロピル基、アリル基などの大きなアルキル基を導入するとモルヒネ拮抗作用が現れる(→こちらを参照)。
をアルキル化すると鎮痛作用は減少する。例えば、メチル基にする(コデイン;Codeine)と活性は5分の1になる。ただし、生体内ではアルキル基は代謝で除去されてフリーの水酸基になるので鎮痛作用を示す。C環の6-水酸基をケトン体に変換、モルヒノン(Morphinone)にすると活性は3分の1に減少するが、モルヒノンの共役二重結合を還元してジヒドロモルヒノン(Dihydromorphinone)にすると活性は6倍に増加する。モルヒネの6-水酸基を除去したもの、すなわち6-デスオキシモルヒネ(6-Desoxymorphine)は活性は10倍に増強される。6位水酸基を除去すると疎水性が増強され薬物吸収率が向上し、活性を増強すると考えられる。芳香族水酸基の導入は確実に活性を減少させる。E環を開裂すると活性は10分の1になり、また前述のモルヒノンの活性が低いのもC環が異性化して芳香族水酸基となるからである。N-メチル基を除去して2級アミン、すなわちノルモルヒネ(Normorphine;アヘン成分の一つで天然有機化合物だが、微量なのでモルヒネより誘導する。半合成オピオイド鎮痛薬の重要な原料)にすると活性は4分の1に減少するが、そのかわり耽溺性も弱くなる。3級アミンを4級アンモニウム塩にすると鎮痛作用は消滅するが、そのかわりクラーレ(ツボクラリンを含む)様の筋弛緩作用を示す。N-メチル基のかわりにプロピル基、アリル基などの大きなアルキル基を導入するとモルヒネ拮抗作用が現れる(→こちらを参照)。
3.オピオイド受容体への作用によるオピオイド鎮痛薬の分類
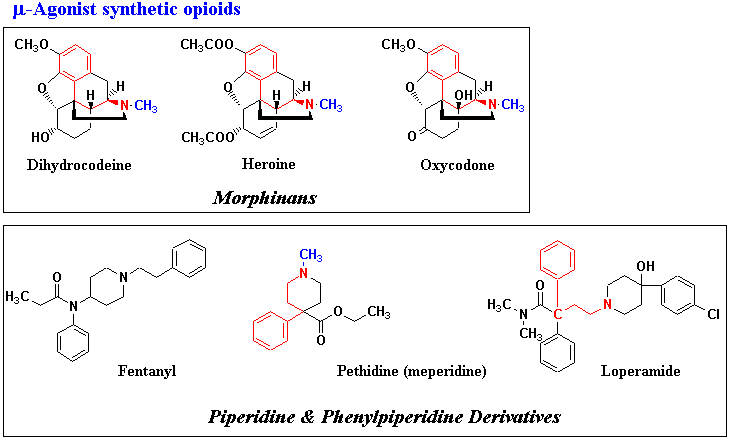
モルヒネとその類縁合成薬物はオピオイド受容体に対する作用から分類することができる。一つはμ受容体作動薬(μ-agonist)であり、図1に主なものを示した。モルヒネと同じ骨格をもつモルヒナン誘導体ジヒドロコデイン(Dihydrocodeine)、ヘロイン(Heroine)、オキシコドン(Oxycodone)もモルヒネと同様の薬物特性をもつμ受容体作動薬である。アヘン(阿片)の化学で述べたようにコデインはアヘンアルカロイドの一つであり、モルヒネと同じく麻薬成分であるが、実はオピオイド受容体への結合能はモルヒネの1000分の1程度にすぎない。受容体への結合にはフリーのフェノール水酸基および平板な周辺構造と塩基性窒素が必要(モルヒネの鎮痛作用のメカニズムを参照)だが、コデインのメトキシ基は完全に受容体への結合を阻害するのである。コデイン(そしてジヒドロコデイン、ヘロイン、オキシコドン)が鎮痛作用、習慣性など麻薬作用を示すのは、体内に散在する薬物代謝酵素P450によってメトキシ基がフリーの水酸基に変換、すなわちモルヒネと同じ機能をもつphenolic alkaloidに変換されオピオイド受容体に作用して鎮痛作用を示すと考えられる。代謝を受けなければ鎮痛作用を示さないヘロインがモルヒネより数倍の鎮痛作用があるのは、ヘロイン分子が疎水性で膜透過しやすくモルヒネよりずっと吸収されやすいという薬物動態特性による効果である。しかし、ヘロインは耽溺性、依存性が強く、現在の麻薬常習者の多くがヘロイン中毒患者であり現在は臨床で用いられることはない。ジヒドロコデインは鎮痛作用は弱いがコデインより強い鎮咳作用があるので、現在では、専ら咳止めの目的でOTC感冒薬に配合される。オキシコドンは鎮痛作用、麻薬中毒作用のいずれもモルヒネよりやや弱い弱オピオイドなので、癌疼痛の制御でモルヒネを使用する前にまず本剤から試されることが多い。
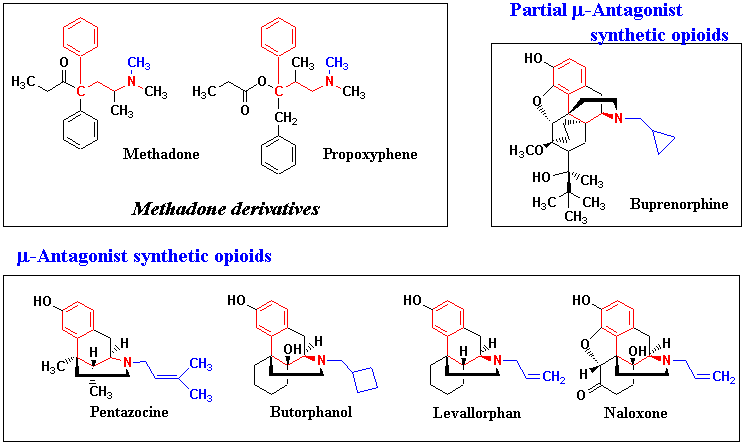
合成鎮痛薬の中には、モルヒナン骨格とはほど遠いピペリジン(piperidine)又はフェニルピペリジン(phenylpiperidine)骨格を有する一群の鎮痛薬がある。フェンタニル(Fentanyl)、ペチジン(Pethidine)(メペリジンMeperidine)、ロペラミド(Loperamide)がこのグループに属し、ロペラミド以外は麻薬性である。これらは別の目的での薬物の開発の途上で、たまたまオピオイド受容体に作用するオピオイド薬物であることがわかったものであり、モルヒネをシードとしたものではない(ペチジンはアトロピン(Atropine)をシードとして開発されたものである)。しかし、フェンタニルを除けば構造を熟視すれば図1の赤い線部に示すようにモルヒネ類縁鎮痛薬との構造的共通性があることがわかる。フェンタニルは前述の表1に示すようにいずれのオピオイド受容体にも作動薬として作用する合成モルヒネ様作動薬であるが、とりわけμ受容体には選択的ともいえるほど強く作用しその鎮痛作用はモルヒネの80倍に達するといわれる。ただし、フェンタニルの持続時間は短いので、フェンタニルパッチとして皮膚から吸収させ、鎮痛補助剤として用いられる。ペチジンはモルヒネと同程度の鎮痛効果を得るのに10倍ほどの用量を必要とするが、モルヒネのような腸のぜん動の抑制効果はないという利点がある。一方、ロペラミドは同じフェニルピペリジン誘導体といいながら、フェンタニル、ペチジンとはかなり異なる薬物特性をもつ。溶解性が低く専ら経口投与で用いられ、また吸収も腸管周辺に限られ、脳には達しないので大量投与によっても多幸感を引き起こさず依存性はない。ただし、モルヒネ類縁鎮痛薬に共通してみられる作用、すなわち腸管オピオイド受容体との相互作用を介した腸管筋肉に対するぜん動抑制作用は保持しているので便秘を起こす。この薬物特性からロペラミドは専ら止瀉薬として用いられる。メタドン(Methadone)系オピオイド(図2)はピペリジン系オピオイドのピペリジン環部が開裂した形のものであり、やはりモルヒネをシードとして開発されたものではない。このグループの薬物にはメタドン、プロポキシフェン(Propoxiphene)などがあるが、μ受容体作動薬であり、構造は全く異なるにも関わらず、薬物特性はモルヒネと質的に類似する。いずれもキラル(不斉)炭素を有するが、薬物としては専らラセミ体が用いられる。メタドンの鎮痛活性はモルヒネ及びその類縁体と同様にほとんどl-体によるもので、d-体はl-体の10~50分の1に過ぎないといわれる。メタドンの鎮痛活性はモルヒネと同程度であるが、モルヒネや多くの類縁鎮痛薬に見られる呼吸抑制など顕著な麻薬中毒作用、嗜好依存作用が弱く、さらに反復使用による効果の低下(モルヒネではモルヒネ耐性といって反復使用すると明瞭な鎮痛効果の減弱がある)が少ないという特性をもつ。メタドンは臨床では癌などによる疼痛の緩和のほか、モルヒネ、ヘロインの禁断症状の治療に用いられる。一方、メタドン類縁体としてプロポキシフェンがあるが、メタドンと比べると鎮痛作用はかなり弱いので、臨床ではアスピリンでは抑えることが困難な軽度~中程度の痛みの治療に用いるにとどまっている。メタドン、プロポキシフェンのいずれも麻薬に指定されている。
μ受容体拮抗薬(図2)はいずれもモルヒネと共通の構造を持つ一方で、窒素に比較的大きなアルキル基をもつという構造的特徴を併せ持つ。このうち、ナロキソン(Naloxone)はκ受容体、δ受容体のいずれも拮抗する完全なモルヒネ拮抗薬であるが、高用量用いた場合でも内在性オピオイドの作用に対する影響は軽微である。ナロキソンはアヘンの急性中毒における呼吸麻痺の治療に用いられる。ただし、慢性中毒の場合はナロキソンの投与で禁断症状が惹起されるので使用は好ましくない。ナロキソンを長期投与したのち、その中断による禁断症状の発現はほとんどない。また、乱用に陥る可能性もほとんどない。ただし、ナロキソンの長期投与で脳内のオピオイド受容体の密度が増加するので、モルヒネ作動薬に対する感受性が一過的に増大することに留意する必要がある。レバロルファン(Levallorphan)はナロキソンに匹敵するμ受容体拮抗作用があり、そのため麻薬拮抗薬に分類されるが、κ受容体に対しても作動薬として作用する点でナロキソンほど明瞭なモルヒネ拮抗薬ではない。そのため、モルヒネより弱いが呼吸抑制作用も示す。一方、ペンタゾシン(Pentazocine)、ブトルファノール(Butorphanol)はμ受容体の弱い拮抗薬であるが、κ受容体に対してはかなり強い作動薬活性を示す。ペンタゾシンはモルヒネの約2分の1の鎮痛効果があるが、κ受容体に対する作動活性に基づく。モルヒネ作動薬による呼吸抑制に拮抗する程ではないが、定期的にモルヒネ作動薬を投与を受けている患者に対しては禁断症状を惹起するなど若干のモルヒネ拮抗作用がある。大量投与ではむしろ不快感を起こすので薬物依存の可能性は低いとして、1966年、WHOはペンタゾシンを麻薬として扱う必要がないとした。しかし、精神異常誘発が起きることがあり、麻薬ではないにしても向精神薬であることに留意する必要がある。ブトルファノールはペンタゾシンと似た薬物特性をもつ非麻薬指定モルヒナン系薬物であり、鎮痛効果はモルヒネの数倍の強さがあるとされる。ペンタゾシンと同様、薬物依存の可能性は低く、大量投与による副作用では嘔気、浮遊感など不快感や精神異常を誘発することがあるが、ペンタゾシンほど著しくない。ブプレノルフィンは前述のμ受容体拮抗薬と同じ構造的特徴を持つが、μ受容体の部分的作動薬(逆に言えば部分的拮抗薬でもある)と考えられている。したがってナロキソンのようにモルヒネ作動薬による作用を完全に阻止することはないが、κ受容体に対しては拮抗的に作用する。モルヒネに比して脂溶性が高く吸収効率が高いため、モルヒネの10~50倍の鎮痛効果があるとされる。ブプレノルフィンは術後、各種癌の疼痛を抑える鎮痛薬として臨床で用いられるが、禁断症状、依存性が弱く薬物乱用の可能性は低いとして非麻薬とされている。
4.モルヒネ則とモルヒネ類縁オピオイド鎮痛薬の構造分類
モルヒネの構造活性相関で得られた知見をもとに、モルヒネをシードとした合成鎮痛薬の創製研究が活発に行なわれた。その最大の目的は鎮痛作用と麻薬作用の分離であったが、目的は達成されたとはいいがたい。しかし、多様な薬物特性をもつ鎮痛薬が多く創製され、疼痛制御を目的とした臨床治療の選択肢が格段に拡大したのは確かである。オピオイド鎮痛薬とはオピオイド受容体に作用する薬物であるが、それらに共通する構造的特徴がありそれを「モルヒネ則」と称している。モルヒネ則は次の3項目からなる。
- 小さなアルキル基(メチル基が最適)をもつ3級窒素が存在する。
- 4級炭素が少なくとも一つあり、その一つにフェニル基が結合する。
- 3級窒素と4級炭素の間に2個のスペーサー炭素がある。
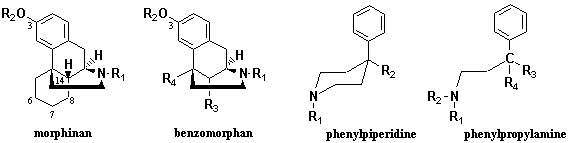
図1、2に挙げたオピオイド薬物でモルヒネ則に合致する部分は赤い線でマークしたが、これはオピオイド受容体に作用する最小限の構造条件にすぎない。これまでに創製された合成オピオイド鎮痛薬を基本骨格で分類(図3を参照)すると、モルヒナン系、ベンゾモルファン(ベンゾアゾシン)系、フェニルピペリジン系、非環状フェニルプロピルアミン系に大別することができる。モルヒナン系合成鎮痛薬は1946年、Greweにより初めて導入されたモルヒネのE環のみを除いたもので、A環には水酸基(またはメトキシ基)のほかは置換基がない、C環には置換基がないほかはモルヒネと同様の構造的特徴をもっている。ブプレノルフィン、ブトルファノール、レバロルファン、ナロキソン、エトルフィン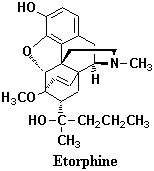 (Etorphine;右に構造式を示す)などが代表的である。これらはモルヒネと異なる薬物特性を持っており、モルヒネの代替薬物ではない。エトルフィンはオピオイド薬物の中でもっとも鎮痛活性が強く、モルヒネの1,000倍に達する。あまりに活性が強すぎるとしてヒトの治療には用いられず、専ら大型動物用の鎮静薬として使われている。動物園などから脱走した興奮した大型動物(ゾウやウシ、トラなど)を麻酔銃で眠らせるというのは時々起きて新聞等で報道されるが、エトルフィンを麻酔銃で発射しこれら大型動物を眠らせるのである。ベンゾモルファンは、1960年、Mayにより導入された化合物群で、モルヒネのC、E環が欠如した骨格であるが活性の発現にはR3、R4にメチル基あるいは小さなアルキル基を必要とする。また、R3はα(トランス)の場合、モルヒネと同レベルの活性であるが、β(シス)では4-30倍の活性を示す。このグループの代表的な薬物はペンタゾシンであるが、R3はα配位である。フェニルピペリジン系に分類されるものはペチジン(メペリジン)とロペラミドがある。R1はメチル基が最適であり、R2は結合数が4の置換基が最適でエステルかケトンである必要がある。フェニル基とR1はアクシャルでなければならない。フェニル基のメタ位に水酸基が導入されると活性は増強する。一方、フェンタニルはピペリジン環を有する化合物であるが、厳密にはモルヒネ則に合致しない。以上述べた3つのグループはいずれも3級アミンが環構造を形成した窒素複素環であるが、オピオイド薬物の中には非環状アミン系のものもある。この場合も中核の基本構造はフェニルプロピルアミンなのでモルヒネ則に合致するが、窒素に大きな置換基を導入してもモルヒネ拮抗薬にはならず、またフェニル基のメタ位に水酸基を導入すると活性はむしろ減少するという特色がある。R3、R4はプロピオニル基とフェニル基(またはベンジル基)の組み合わせが必要で、l-体であることが活性発現に必要である。
(Etorphine;右に構造式を示す)などが代表的である。これらはモルヒネと異なる薬物特性を持っており、モルヒネの代替薬物ではない。エトルフィンはオピオイド薬物の中でもっとも鎮痛活性が強く、モルヒネの1,000倍に達する。あまりに活性が強すぎるとしてヒトの治療には用いられず、専ら大型動物用の鎮静薬として使われている。動物園などから脱走した興奮した大型動物(ゾウやウシ、トラなど)を麻酔銃で眠らせるというのは時々起きて新聞等で報道されるが、エトルフィンを麻酔銃で発射しこれら大型動物を眠らせるのである。ベンゾモルファンは、1960年、Mayにより導入された化合物群で、モルヒネのC、E環が欠如した骨格であるが活性の発現にはR3、R4にメチル基あるいは小さなアルキル基を必要とする。また、R3はα(トランス)の場合、モルヒネと同レベルの活性であるが、β(シス)では4-30倍の活性を示す。このグループの代表的な薬物はペンタゾシンであるが、R3はα配位である。フェニルピペリジン系に分類されるものはペチジン(メペリジン)とロペラミドがある。R1はメチル基が最適であり、R2は結合数が4の置換基が最適でエステルかケトンである必要がある。フェニル基とR1はアクシャルでなければならない。フェニル基のメタ位に水酸基が導入されると活性は増強する。一方、フェンタニルはピペリジン環を有する化合物であるが、厳密にはモルヒネ則に合致しない。以上述べた3つのグループはいずれも3級アミンが環構造を形成した窒素複素環であるが、オピオイド薬物の中には非環状アミン系のものもある。この場合も中核の基本構造はフェニルプロピルアミンなのでモルヒネ則に合致するが、窒素に大きな置換基を導入してもモルヒネ拮抗薬にはならず、またフェニル基のメタ位に水酸基を導入すると活性はむしろ減少するという特色がある。R3、R4はプロピオニル基とフェニル基(またはベンジル基)の組み合わせが必要で、l-体であることが活性発現に必要である。
5.絶対構造と鎮痛活性の相関
前述したように、合成鎮痛薬の多くはモルヒナン、ベンゾモルファン(ベンゾアゾシン)、フェニルピペリジンあるいはフェニルプロピルアミン骨格(図3を参照)を有し、いずれもキラル炭素をもつ。天然物としてはオオツヅラフジに含まれるアルカロイドシノメニンはモルヒナン骨格をもつが、非オピオイド化合物である。平面相対構造はモルヒネと同じだが、その立体構造は光学的に逆のd-体であり、モルヒネ様の鎮痛活性はほとんどないからである。オピオイド鎮痛薬でも強い鎮痛活性を有するものはモルヒネでいえばl-体の系統に属し、その鏡像体であるd-体はほとんど鎮痛活性がないか、もしくは活性が大幅に減弱する。かか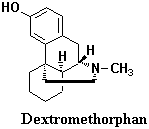 る化合物は鎮痛薬としては役に立たないが、それが逆に利点となっているものもある。デキストロメトルファン(Dextromethorphan)はその好例であり、d-体のモルヒナン構造をもち、コデインに匹敵する鎮咳作用をもつ一方で鎮痛作用も嗜癖性もないので、非麻薬性鎮咳薬として価値が高い。コデイン、デキストロメトルファンのいずれも薬理学的には中枢作用性鎮咳薬とされるものであり、咳反射に関与する中枢あるいは抹消神経に作用する結果、咳が抑えられる。アヘンに含まれるアルカロイドのうち、ノスカピン(Noscapine)は非麻薬性の鎮咳薬であるが、これも中枢作用性である。咳は有益な生理学的機転であり、異物や分泌物を除くのに役立っているという視点からはむやみに鎮咳薬を処方するのは決して好ましくない。そのため咳の頻度や強度を減ずるような治療法を選択すべきであるといえる。中枢作用性鎮咳薬は気道分泌を抑制せず、またアドレナリン作動薬に代表される気管支拡張薬と比べると、中枢興奮、血圧上昇などを伴うこともないので、風邪のような軽微な症状の咳止めに繁用される。デキストロメトルファンは優れた鎮咳薬であるが、残念ながら高価であるためOTC薬のような廉価な薬に配合されることはない。
る化合物は鎮痛薬としては役に立たないが、それが逆に利点となっているものもある。デキストロメトルファン(Dextromethorphan)はその好例であり、d-体のモルヒナン構造をもち、コデインに匹敵する鎮咳作用をもつ一方で鎮痛作用も嗜癖性もないので、非麻薬性鎮咳薬として価値が高い。コデイン、デキストロメトルファンのいずれも薬理学的には中枢作用性鎮咳薬とされるものであり、咳反射に関与する中枢あるいは抹消神経に作用する結果、咳が抑えられる。アヘンに含まれるアルカロイドのうち、ノスカピン(Noscapine)は非麻薬性の鎮咳薬であるが、これも中枢作用性である。咳は有益な生理学的機転であり、異物や分泌物を除くのに役立っているという視点からはむやみに鎮咳薬を処方するのは決して好ましくない。そのため咳の頻度や強度を減ずるような治療法を選択すべきであるといえる。中枢作用性鎮咳薬は気道分泌を抑制せず、またアドレナリン作動薬に代表される気管支拡張薬と比べると、中枢興奮、血圧上昇などを伴うこともないので、風邪のような軽微な症状の咳止めに繁用される。デキストロメトルファンは優れた鎮咳薬であるが、残念ながら高価であるためOTC薬のような廉価な薬に配合されることはない。