1.オルニチン由来のアルカロイド
後述するように、ナス科植物にはトロパン骨格を有するアルカロイドを含むものがあり、アルカロイドたる窒素源はオルニチン(Ornithine)という塩基性アミノ酸に由来する。オルニチンは脱炭酸を受けてプトレシン(Putrescine)なるジアミンに変わり、さらにジアミンオキシダーゼの作用で酸化されてγ-アミノブチルアルデヒドを生成する。そしてアミノ基とアルデヒド基との間のマンニッヒ(Mannich)反応による分子内縮合でこの物質は5員環のΔ1-ピロリン(Pyroline)となる。いわゆるピロリジン(pyrrolidine)アルカロイドと称されるものはほとんどこの中間体を経て生合成される。中間体としてプトレシンを経るため、オルニチンの2位に標識された同位元素はピロリジン環では窒素を挟んで対称型に分布する。図1ではコカノキ科コカノキErythroxylon cocaに含まれるコカイン(Cocaine)およびナス科アルカロイドの一つヒヨスチアミン(Hyoscyamine)の生合成経路を示す。コカインとヒヨスチアミンはΔ1-ピロリンにアセト酢酸(acetoacetyl)CoAが縮合していわゆるトロパン(tropane)骨格を形成するので、酢酸-マロン酸経路との複合経路で生合成されることになる。コカインではアセト酢酸由来のカルボン酸が保持されるのに対して、ヒヨスチアミンほかナス科トロパンアルカロイドでは失われている点が異なっている。また、オルニチンの2位に標識された同位元素はトロパン骨格では非対称に分布するのでN-CH3はオルニチンの段階で導入されたと考えられている。ニコチンは特殊なアミノ酸であるニコチン酸を前駆体とする複合経路で生合成される。ヒヨスチアミンは光学活性体であるが、分子内に存在する唯一の不斉炭素(トロパ酸tropic acid内にある)は活性メチンであるため、ごく弱い条件で光学純度が失われる。そのため医薬品としては弱アルカリでラセミ化させたものを用い、これをアトロピン(Atropine)と称する。因みに、トロパン骨格内に不斉炭素があるように見えるが、左右対称のmeso体であるため光学的に不活性である。
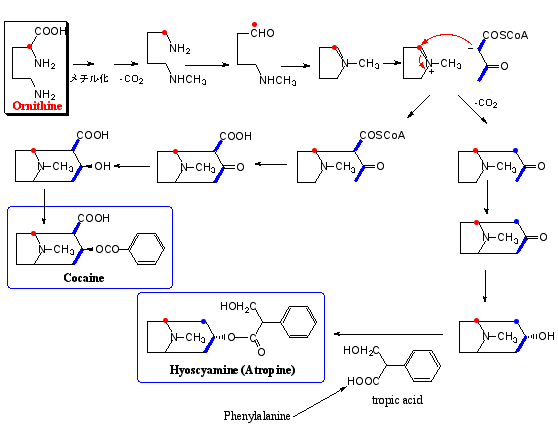
アトロピンおよび類縁トロパンアルカロイドはナス科植物に散見され、ヒヨス(Hyoscyamus)属のほかチョウセンアサガオ(Datura)属、ハシリドコロ(Scopolia)属、ベラドンナ(Atropa)属などにも含まれる。薬理活性としてアセチルコリンによる神経伝達を抑制する作用があり、副交感神経遮断薬として有用である。特に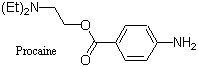 地下鉄サリン事件で中毒患者に対して解毒薬としてアトロピンが処方されたことはよく知られる。コカインに関しては局所麻酔薬として有用であるが、中枢神経を興奮させ、快活多弁を誘うほか疲労感を消失させる作用がある。しかし、多量投与で幻覚、錯乱を生じ、また薬物依存性があるので麻薬に指定されている。今日のわが国ではコカインを用いることはほとんどなく、局所麻酔薬の大半はコカインをモデルとして創製された合成薬プロカイン(右構造式;Procaine)である。
地下鉄サリン事件で中毒患者に対して解毒薬としてアトロピンが処方されたことはよく知られる。コカインに関しては局所麻酔薬として有用であるが、中枢神経を興奮させ、快活多弁を誘うほか疲労感を消失させる作用がある。しかし、多量投与で幻覚、錯乱を生じ、また薬物依存性があるので麻薬に指定されている。今日のわが国ではコカインを用いることはほとんどなく、局所麻酔薬の大半はコカインをモデルとして創製された合成薬プロカイン(右構造式;Procaine)である。
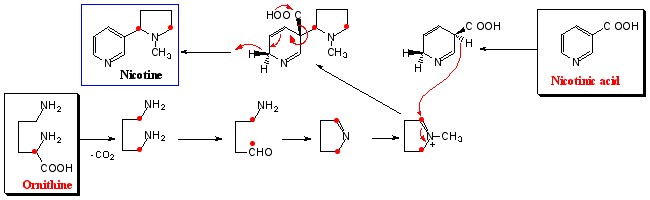
ナス科タバコNicotiana tabacumにはピロリジン(pyrrolidine)環とピリジン(pyridine)環が結合した珍しいアルカロイドであるニコチンが含まれる。ピロリジン環はオルニチンに由来し、ピリジン環はニコチン酸(Nicotinic
acid)が図2のような脱炭酸を含むメカニズムで生成する。すなわち、2種類のアミノ酸に由来する変則的複合経路で生合成される。
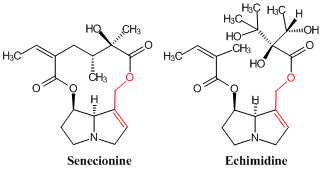
オルニチンから生成する複素環はピロリジンのほか、ピロリチジン(pyrolizidine)がある。プトレシンとそれが酸化されて生成するブタン-1,4-ジアル(butane-1,4-dial)が図3のマトリンの生合成と同様な経路でピロリチジンが構築される。キク科キオン(Senecio)属植物の中にはアリルオキシエステルの部分構造(下の構造式の赤い部分))をもつピロチジンアルカロイドが知られている。ノボロギクに含まれるセネシオニンはその一つであるが、肝臓毒性があって肝臓癌を誘発するといわれている。発癌のメカニズムとして、ピロリチジン環が脱水素酸化されてピロールに変換したのち、分解して生成するアリルカチオンにDNAが付加すると考えられている。
葉をコンフリーと称して食用にするムラサキ科ヒレハリソウからエチミジンというよく似たアルカロイドが得られている。含量は低いが、セネシオニンと同じアリルオキシエステルの部分構造をもつので、厚生労働省は長期摂取によって肝障害の可能性があるとして、ヒレハリソウを食材とする食品の販売を禁止している(→コンフリーを含む健康食品などに関する注意)。わが国ではヒレハリソウの摂食はあまり一般的ではないが、海外では肝障害の健康被害が多発している事実がある。
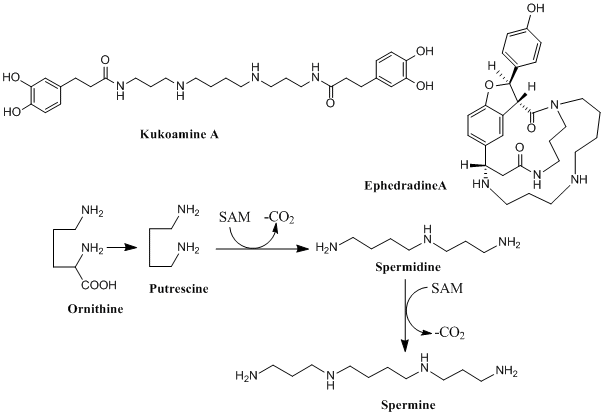
以上述べたオルニチン由来のアルカロイドは、すべてプトレシンが環化して生成したピロリジンあるいはピロリチジンという複素環をもつが、鎖状のままアルカロイドに取り込まれることもある。ポリアミン系アルカロイドはその一例で、図3に示すように、S-アデノシル-L-メチオニン(S-Adenosyl-L-methionine;SAM)が脱炭酸して生成したデカルボキシル-S-アデノシル-L-メチオニン(dcSAM)とプトレシンからスペルミジンを経て生成するスペルミンを前駆体とする。因みにスペルミンのC4鎖がオルニチン、C3鎖がSAMに由来する。ナス科クコ、ナガバクコの根(生薬名:地骨皮)に含まれるクコアミンAはスペルミンに2分子の3,4-ジヒドロキシピルビン酸が作用してアミド体となったものである。地骨皮は滋陰至宝湯、清心蓮子飲など後世方派の処方に配合され、消炎、清涼解熱、強壮などの効があるとされる。漢方ではまず使われることはないが、マオウ科シナマオウの根を麻黄根と称し、産前産後の盗汗(睡眠中に出る寝汗)に用いられる。興味深いことに、シナマオウの根からエフェドラジンAなど止汗作用をもつアルカロイドが知られている。スペルミンにケイヒ酸誘導体2分子からなるネオリグナンと縮合して大環状化合物となった構造は珍しい。
2.リジン由来のアルカロイド
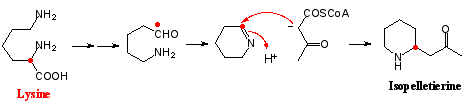
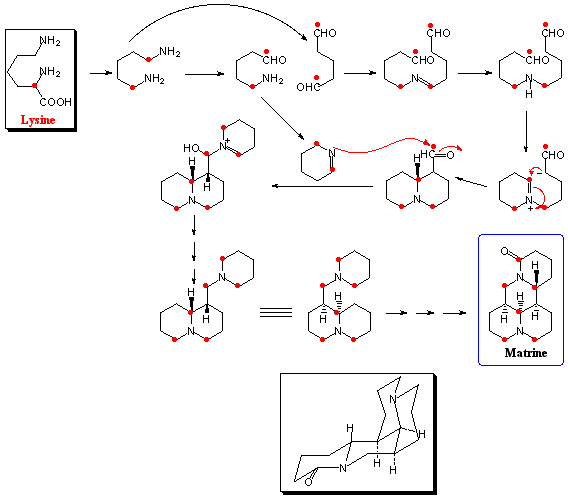
リジン(Lysine)はオルニチンより一つ炭素鎖が多い塩基性アミノ酸であり、脱炭酸して生成するカダベリン(Cadaverine)を経てオルニチンの場合と同様なメカニズムで6員環のΔ1-ピペリン(Piperine)を形成する。キキョウ科ミゾカクシなど同属植物に含まれるロベリンは代表的なピペリジンアルカロイドの一種である。天然界には複数のピペリジン(piperidine)環が縮合した二次代謝産物が多く見られ、マメ科クララに含まれるマトリン(Matrine)はその一例である。その生合成経路を図4にあげるが、カダベリンからδ-アミノペンチルアルデヒトとジアルデヒドが生成し、これらが縮合してまずキノリチジン(quinolizidine)環が形成される。その後にΔ1-ピペリンと縮合して4環性のマトリンが生合成される。天然にはキノリチジン環を有するアルカロイドが多く存在し、特にマメ科ルピナス(Lupinus)属に多いので、この骨格を有するものをルピナン(lupinane)と総称することがある。この場合、リジンの2位のラベルは対称型に分布するが、非対称型のケースも多くあり、必ずしも同じメカニズムで閉環するとは限らないようである。マトリンもルピナンも苦味の強いことで知られ、特にクララの根は生薬クジンとして苦味健胃薬として用いられる。
一方、ザクロ科ザクロの樹皮からもイソペレチエリン(Isopelletierine)というピペリジンアルカロイドが知られている。このアルカロイドはセリ科ドクニンジンの有毒成分コニイン(酢酸-マロン酸経路で生合成される)に酷似するが、生合成的には全くの別物であって、リジンとアセト酢酸CoAとの複合経路で生合成される。この場合も、リジンの2位の14C-ラベルは非対称的にイソペレチエリンに継承される。