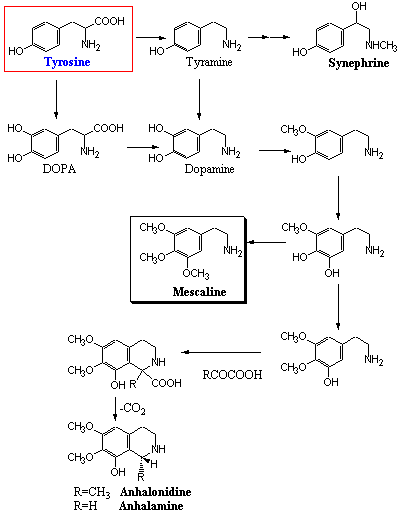
1.フェネチルアミンアルカロイドの生合成
芳香族アミノ酸は脱炭酸を受けるとフェネチルアミン誘導体になる。チロシン(Tyrosine)はチラミン(Tyramine)に変わり、チラミンの3位に水酸基が導入されたものがドパミン(Dopamine)である。ドパミンはチロシンの3位に水酸基が導入された3,4-ジヒドロキシフェニルアラニン(DOPA)が脱炭酸されて生成することもある。チラミン・ドパミンいずれもアルカロイドの生合成前駆体となり得る。ミカン科カンキツ属(ウンシュウミカン、ナツミカン、ダイダイ)に含まれるシネフリンやサボテン科ウバタマ(烏羽玉)に含まれる幻覚成分メスカリンはチラミンドパミン由来のもっとも簡単なフェネチルアミン系アルカロイドである。また、ウバタマにはテトラヒドロイソキノリン系化合物(Anhalonidineなど)が多く知られているが、生合成的にはフェネチルアミン中間体とピルビン酸(R=CH3)またはグリオキシル酸(R=H)との縮合で生成する。
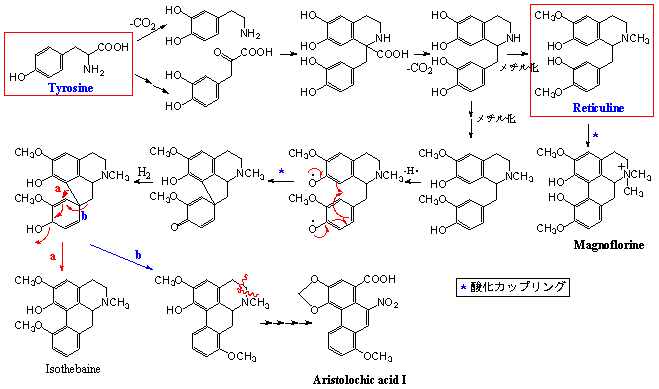
2.ベンジルイソキノリンアルカロイドの生合成
チロシンに由来するアルカロイドで最大のグループを擁するのはベンジルイソキノリンアルカロイドと総称されるものである。この生合成経路はドパミンとDOPAから生成したケトカルボン酸が縮合、脱炭酸してできるレチクリン(Reticuline)に由来する。芳香環の間に結合ができて4環性となったものがアポルフィン(aporphine)型アルカロイドであり、ホオノキに含まれるマグノフロリン(Magnocurarine)はその一例である。結合の生成メカニズムに関しては直接酸化カップリングで生成する場合と、酸化カップリングで一旦スピロ4環性中間体を経て還元、転位で生成するものに大別される。後者のタイプはベンジル基上の酸素官能基が失われているのが特徴である。ウマノスズクサを始めとするウマノスズクサ属に広く含まれる腎障害性物質アリストロキア酸はフェナンスレン骨格にニトロ基を有する特異な構造であるが、スピロ4環性中間体においてbの転移が生じて生成する変形アポルフィン型アルカロイドであり、真正アルカロイドの一種とみるべきである。
ケシ科ケシの未熟果実に傷をつけて出る乳液を集めて乾燥したものがアヘン(opium)(→詳細はアヘン(阿片)の基原、化学、麻薬成分の全てを参照)であり、有史以来、麻薬として知られている。その主成分は鎮痛作用を有するモルヒネ(Morphine)であるが、その複雑な骨格(モルヒナン; morphinane)は前述のレチクリン((-)-体)に由来する(→モルヒナンがベンジルイソキノリンの誘導体であることは図3の生合成経路でも明らかであるが、別ページにも解説する)。すなわち、ベンジル基上の水酸基のオルト位とテトラヒドロイソキノリン環上の水酸基のパラ位との間で酸化カップリングが起きて炭素-炭素結合が生じるとモルヒナン骨格をもつサルタリジン(Salutaridine)ができる。ケトンが還元されサルタリジノール(Salutaridinol)となり、脱水反応が起きるとともにエーテル環が形成されテバイン(Thebaine)となり、コデイン(Codeine)を経て最後に3位の脱メチルが起きてモルヒネとなる。ケシにはモルヒネのほかにコデイン、ノスカピン(Noscapine)、パパベリン(Papaverine)が含まれ、前二者は鎮咳薬、後者は鎮痙薬として有用であるが、ノスカピンを除いていずれもベンジルイソキノリンアルカロイドに属する。ノスカピンは次に述べるベルベリン型アルカロイドの変形であり、フタリドの部分構造を有する。以上4つのアルカロイドのうち、ノスカピンとパパベリンは非麻薬成分である。アヘンアルカロイドの主成分はモルヒネであり、10~20%含まれる。わが国では毎年100トンほどのアヘンを輸入しているが、大半は大衆咳止め薬であるジヒドロコデイン(Dihydrocodeine)を製造するために使われる。しかし、近年では硫酸モルヒネの経口投与で末期癌患者の疼痛のコントロールに有効である(麻薬中毒にはならない)ことがわかり、さらにMSコンチン錠のような徐放剤が開発されるに伴い、モルヒネの使用量の飛躍的な増大が見込まれている。

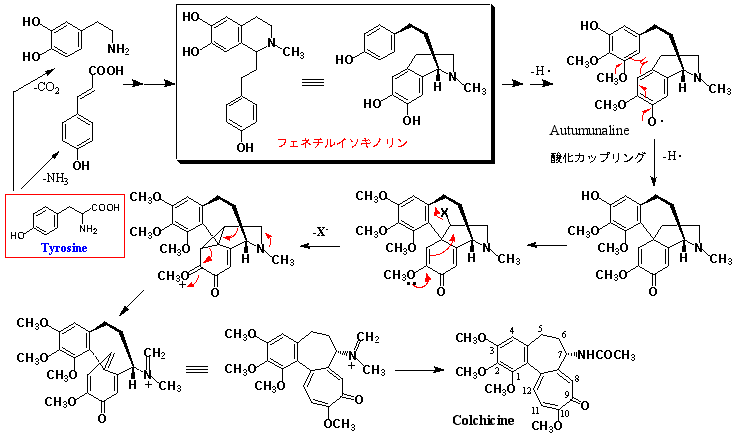
3.コルヒチンの生合成
コルヒチン(Colchicine)はイヌサフラン科イヌサフランに含まれ、トロポロン(tropolone)骨格を有する珍しい構造をもつ含窒素化合物である。3環性でありながら窒素原子が環の中に含まれない非複素環化合物であり、しかもアミドであるため塩基性を示さない。典型的なアルカロイドには見えないが、生合成的見地からすればコルヒチンは純然たる真正アルカロイドの1種である。標識化合物を用いた投与実験で、コルヒチンのA環部およびC-5、C-6、C-7はフェニルアラニンに由来することが明らかにされている。その結果、コルヒチンのユニークな基本骨格は、図4に示すように、ドーパミン(またはチラミン)とケイヒ酸が縮合してできるフェネチルテトラヒドロイソキノリンが酸化カップリング、転位、環拡大反応を経て生合成されると推定されている。この生合成スキームで中間体とされるフェネチルテトラヒドロイソキノリン誘導体アウタムナリン(Autamnaline)はイヌサフランの同属近縁種Colchicum cornigerumから実際に単離されている。ベンジルイソキノリンアルカロイドが比較的広く分布するのに対してコルヒチンなどフェネチルイソキノンアルカロイドは天然界では極めてまれで、ほかにイチイ科イヌガヤのセファロタキシンが同中間体を経て生合成されると推定されているに留まる(→こちら)。
イヌサフランの種子は欧州において17世紀から通風治療に用いられていたが、その活性成分としてコルヒチンが単離されたのは1886年のことであった。コルヒチンは今日でも抗通風薬として用いられるが、その他、細胞分裂において紡錘糸の形成を阻害するというユニークな生物活性が知られている。一方で染色体分裂は阻害しないので、コルヒチン処理により倍数体の細胞ができる。これを利用して農業分野において種なし果実などをつくるのに利用されている。
4.ベルベリン型とその類縁アルカロイドの生合成
大衆下痢止め薬の中で塩化ベルベリンはもっとも普通に用いられるが、ミカン科キハダの樹皮(生薬オウバクの基原)に含まれるベルベリン(Berberine)から製造されたものである。ベルベリンは他にキンポウゲ科オウレンの根(生薬オウレンの基原)にも含まれるが、生合成的にはレチクリンに由来するベンジルイソキノリンアルカロイドの一種である。レチクリンのN-CH3(ベルベリンブリッジ炭素となる)が酸化され、脱水してイミドを生成し、図5—1のようなメカニズムで閉環して4環性のテトラヒドロベルベリン(Tetrahydroberberine)となり、ベルベリンはこれがさらに酸化をうけて生成する。ベルベリンは生薬オウバク、オウレンの薬効成分として重要であるが、その名がメギ科メギ属の属名(Berberis)に由来することからわかるように、メギをはじめとするメギ科植物に類縁物質が広く分布する。ベルベリン、テトラヒドロプロトベルベリン型アルカロイドは以上述べたキンポウゲ科、ミカン科、メギ科のほか、ケシ科、バンレイシ科、ツヅラフジ科にも含まれる。テトラヒドロベルベリンは大環状化合物プロトピン(protopine)型や、ベンゾ[c]フェナンスリジン(benzo[c]phenanthridine)型アルカロイドに変換される。プロトピン型はケシ科だけに見られる化合物群であり、エンゴサクほか同属植物にプロトピンが含まれ、ケシにも存在する。ベンゾ[c]フェナンスリジン型はケシ科のほか、イヌザンショウ、カラスザンショウなどのミカン科にも散見される。サンギナリン(Sanguinarine)はクサノオウやタケニグサなどケシ科でもっとも広く分布するベンゾ[c]フェナンスリジン型アルカロイドの一つである。(→関連ページ)
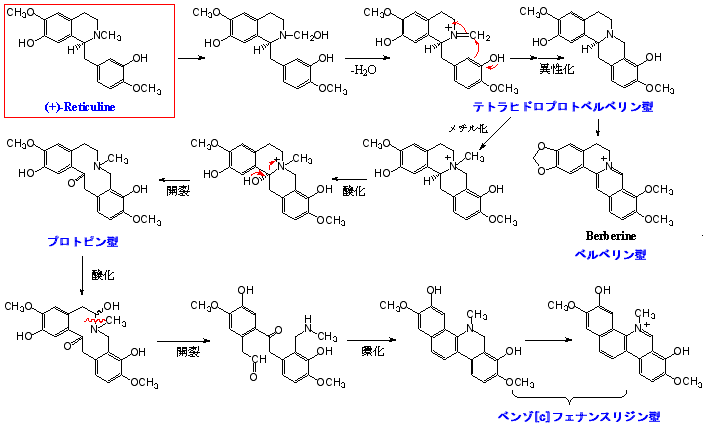
一方、ケシ科ケシには前述のモルヒナン系アルカロイドのほか、ノスカピンを始めとするフタリドイソキノリン型アルカロイドと総称される成分群を含む。フタリド環を構成するC1単位はベルベリンブリッジ炭素に由来するものであり、図5−2に示すように、テトラヒドロベルベリンを経て生合成される。また、ヒナゲシPapaver rhoeasに含まれるロエアジン(Rhoeadine)はユニークな構造をもつが、ケシを含むケシ属各種にはその類縁体が多く知られている。このケシ属に特有の成分群をロエアジン型アルカロイドと称する。ロエアジン骨格は、図5−2に示すように、プロトピンの大環状部が開裂、再閉環によって構築されると考えられる。特筆すべきことは、モルヒネなどモルヒナンと同じレチキュリンを前駆体とするベンジルイソキノリンアルカロイドでありながら、ノスカピンは明らかに(+)-レチキュリンに由来し、モルヒネなどモルヒナンとは立体化学的に逆の系統である。アヘンには多くのテトラヒドロプロトベルベリン型アルカロイドの存在が明らかにされているが、いずれも立体化学的に(+)-レチキュリンの系統である(→詳しくはアヘン(阿片)の基原、化学、麻薬成分の全てを参照)。また、(+)-レチキュリンそのものもアヘン成分の一つであることが知られている。一つの植物種においてそれぞれ異なる鏡像体が生合成前駆体となる例はきわめて稀といわざるを得ないが、これを説明するにはレチキュリンの両鏡像体がデヒドロレチキュリニウムを介してメタボリックグリッドを構成していると考えざるをえない。つまり、実際にアヘンアルカロイドとして単離されている(+)-レチキュリンが本来の代謝物(native metabolite)であり、メタボリックグリッドで(-)-レチキュリンに変換された後、モルヒネなどモルヒナンアルカロイドに前駆体として取り込まれるのである。このことは標識化合物を用いた実験でも実証されている。

5.ヒガンバナ科アルカロイドの生合成
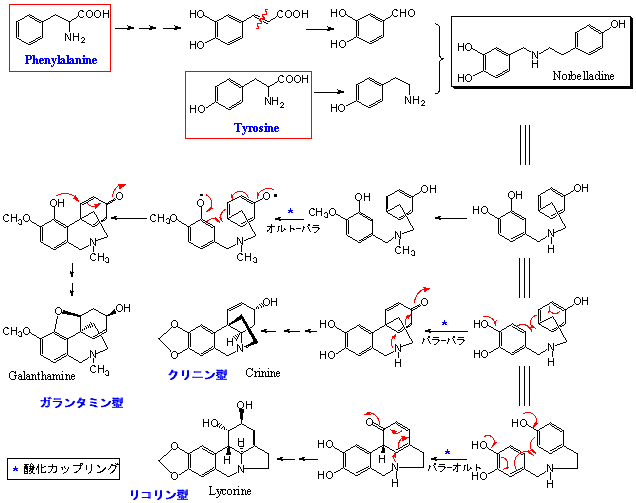
ヒガンバナ科ヒガンバナにはリコリン(Lycorine)、ガランタミン(Galanthamine)などの特異なアルカロイドを含むことで知られる。類似のアルカロイドはヒガンバナ属に限らず、ハマオモト(Crinum asiaticum)など広くヒガンバナ科に見られるので、これらを総称してヒガンバナ(科)アルカロイドと称する。生合成的にはチラミンとカフェ酸(Caffeic acid)から生成する3,4-ジヒドロキシベンズアルデヒドとが縮合したノルベラジン(Noebelladine)を前駆体として創られる。ノルベラジンの閉環様式によりリコリン型、クリニン(crinine)型、ガランタミン型の3つに大別される。第一段階の閉環はいずれも酸化カップリングによって起こり、オルト-パラで結合すればガランタミン型、パラ-パラではクリニン型、パラ-オルトはリコリン型を生成する。
6.イヌガヤアルカロイドの生合成
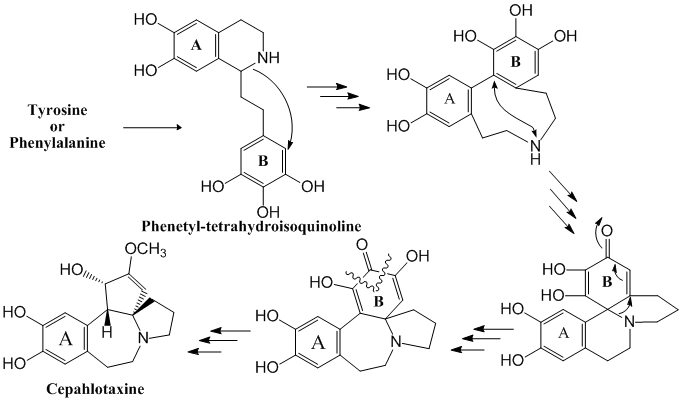
イチイ科イヌガヤにはセファロタキシン(Cephalotaxine)ほか特異な構造をもつ抗腫瘍性アルカロイドが知られている。その生合成は十分に解明されているとはいいがたいが、2分子のチロシンあるいはフェニルアラニンからまずフェネチルテトラヒドロイソキノリン(Phenetyl-tetrahydroisoquinoline)を生成し、図7に示すようなメカニズムで生成すると考えられる。フェネチルテトラヒドロイソキノリンを中間体とするアルカロイドはイヌサフランに含まれるコルヒチンの例があり(3.コルヒチンの生合成)、また大環状中間体を経由して各環が構築されるところは後述のエリスリナアルカロイドの例がある。
注目すべきことに、最近、イヌガヤの微量成分ハリントニン(Harringtonine)が慢性骨髄性白血病患者の治療薬として米国で認可された(商標名:Omacetaxine mepesuccinate)。極微量成分であるため、セファロタキサン環部は天然物、側鎖残基を合成で調製し、両者を結合させる半合成法で治療用のハリントニンを供給しているところはパクリタキセルと同様である。
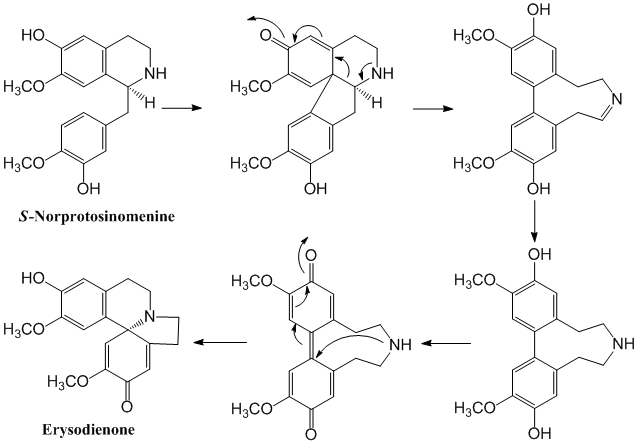
7.エリスリナアルカロイドの生合成
マメ科デイゴほか同属植物にはエリスラリンを始めとするエリスリナアルカロイドと総称される一群の4環性アルカロイドが含まれる。その生合成経路はベンジルテトラヒドロイソキノリン(Benzyl-tetrahydroisoquinoline)を経由して、図8に示すように、進行することが確認されている。エリスリナアルカロイドは非常に多くの成分が報告されているが、生物活性については注目すべきものはなく、また毒性もさほど強くないようである。